
[解析事例] 反応のエネルギー変化
- 量子化学・DFT
- その他の特性
- マテリアルサイエンス
目的と手法
図1に示した3種類の金属の酸化反応のエネルギー変化(ΔE)を求めました。
Mg + 1/2 O2 → MgO
Si + O2 → SiO2
2Al + 3/2 O2 → Al2O3
エネルギー変化(ΔE)は以下の式から求められ、酸化物の生成エネルギーに相当します。図2にMgの計算に用いたモデルを示します。各状態でのエネルギーを計算し、反応前後のエネルギー差からΔEを求めます。計算はSIESTAを用いて行い、汎関数にPBE、基底関数にDZP(EnergyShift = 0.2 eV)を適用しました。(MeshCutoff: 300.0 Ry、kgrid_cutoff: 10.0 angstrom)
E(Mg) + 1/2 E(O2) = E(MgO) + ΔE
E(Si) + E(O2) = E(SiO2) + ΔE
2E(2Al) + 3/2 E(O2) = E(Al2O3) + ΔE
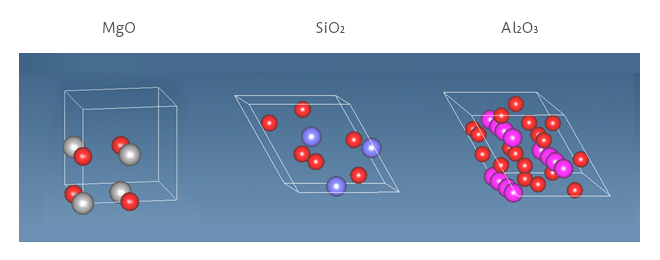 図1 酸化物のモデル
図1 酸化物のモデル
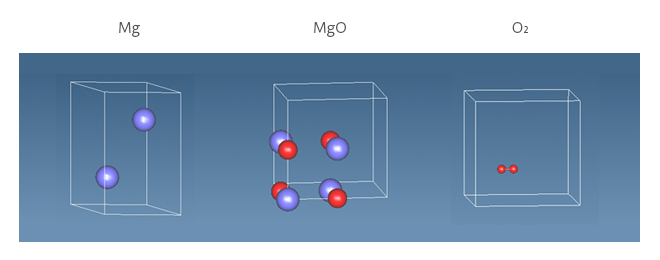 図2 MgO反応エネルギー計算に用いたモデル
図2 MgO反応エネルギー計算に用いたモデル
解析結果
解析結果を図2に示します。どの金属でも参照値とよく一致した結果が得られ、SIESTAで反応時のエネルギー変化の評価が可能なことを示しました。
※ 参照値は酸化物の生成エンタルピー(ΔH=ΔE+ΔPV)であるため計算量とは厳密には一致しませんが、固体の場合PVの寄与は小さいと考えられるため近似値として比較しています。
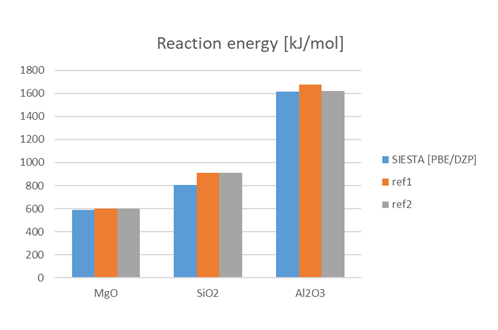 図3 反応のエネルギー変化の計算結果と文献値との比較
図3 反応のエネルギー変化の計算結果と文献値との比較
ref1: https://doi.org/10.1155/2014/120840
ref2: NIST Chemistry Webbook (https://doi.org/10.18434/T4D303)
事例一覧
- ※記載されている製品およびサービスの名称は、それぞれの所有者の商標または登録商標です。





